Hydrożele, jak nazwa wskazuje, to żele na bazie wody. Najprostszym przykładem hydrożelu jest zwykła spożywcza galaretka. Składa się ona przede wszystkim z wody, a substancją, która utrzymuje jej konsystencję, tzw. substancją sieciującą, jest żelatyna. Żelatyna to naturalny polimer – białko złożone z aminokwasów. Naturalny polimer można jednak zastąpić takim otrzymanym na drodze syntezy chemicznej. Dzięki temu hydrożel zyskuje nowe właściwości. Rozwijaniem możliwości hydrożeli zajmuje się zespół naukowców z Wydziału Chemii i Centrum Nauk Biologiczno-Chemicznych UW pod kierownictwem dr. hab. Marcina Karbarza, prof. ucz.
Opatrunki muszą sprostać wielu wyzwaniom
– Gojenie ran to proces skomplikowany. Jest wiele czynników, które wpływają na to, że rany nie leczą się tak, jak powinny. Z jednej strony to czynniki zewnętrzne, jak na przykład nadkażenie ran. Z drugiej strony czynniki wewnętrzne, różne choroby – nowotworowe, cukrzyca – także powodują, że rany nie chcą się leczyć. W przypadku trudno gojących się ran, materiały hydrożelowe, ze względu na swoje właściwości, są bardzo dobrym kandydatem do tego, aby wykonywać z nich opatrunki i plastry – tłumaczy prof. Marcin Karbarz. Dlaczego tak się dzieje?
– Hydrożele zapewniają odpowiednią wilgotność, która jest potrzebna do kontrolowania procesu leczenia. Posiadają odpowiednie właściwości mechaniczne, tzn. dostosowują się do kształtu rany. Są transparentne, co pozwala monitorować, jak rana się leczy. Kolejną ich przewagą jest to, że są przepuszczalne dla gazów, również potrzebnych w procesie leczenia. A równocześnie są barierą, która izoluje ranę od zewnętrznego środowiska, chroniąc ją przed nadkażeniem – wylicza naukowiec. – Co więcej, substancja lecznicza znajdująca się w żelu, jest uwalniana do rany w sposób kontrolowany, dzięki czemu proces leczenia jest odpowiednio przyspieszony – dodaje badacz.
Materiały hydrożelowe szczególnie dobrze sprawdzają się w leczeniu ran powstałych na skutek poparzeń. Hydrożele zapewniają cały czas środowisko wilgotne, które łagodzi dolegliwości bólowe, a równocześnie można wprowadzić do nich dodatkowe substancje, które będą wspomagać proces leczenia.
Jak powstają hydrożele do zadań specjalnych?
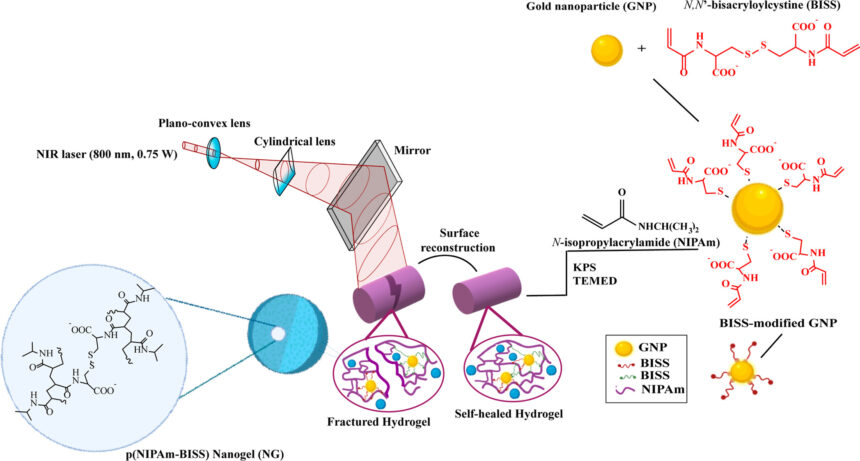
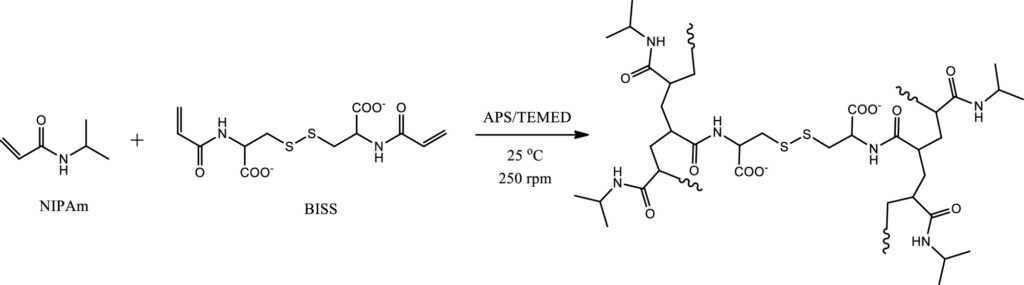
Badacze zajęli się hydrożelem na bazie termoczułego polimeru. Materiał ten sfunkcjonalizowali, wprowadzając do jego struktury nanożel, czyli żel o bardzo małych cząstkach, oraz odpowiednio zmodyfikowane nanocząstki złota. Dodatki te nadały temu materiałowi pożądane, specyficzne właściwości. Wprowadzenie nanożelu – upraszczając – spowodowało zwiększone zmiany struktury hydrożelu w zależności od temperatury oraz poprawiło przewodnictwo cieplne, co jest kluczową cechą w kontrolowanym uwalnianiu leków. Przełomowym pomysłem było wprowadzenie do hydrożelu nanocząstek złota. Dzięki oddziaływaniom złoto-siarka otrzymany hydrożel odznaczał się większą wytrzymałością mechaniczną i, podobnie jak w przypadku nanożelu, szybszą reakcją na temperaturę. Pod wpływem ciepła zawarty w nim lek mógł być intensywniej wypuszczany z materiału – naukowcy obliczyli, że uwalnianie leku ze modyfikowanego hydrożelu było o 93% większe w porównaniu z jego wcześniejszą wersją.
Nowy hydrożel wykazywał także większe zdolności do samonaprawy – odnotowano 85% regeneracji po dwóch minutach działania lasera emitującego promieniowanie z zakresu bliskiej podczerwieni (NIR, ang. Near InfraRed). Tę właściwość żele zawdzięczają właśnie nanocząstkom złota, ponieważ mają one zdolność pochłaniania promieniowania w tym zakresie. Istotne jest tutaj chemiczne połączenie, które uzyskali naukowcy, a więc oddziaływanie złoto-siarka, które może być odwracalnie „przełączane” za pomocą lasera NIR. Skąd ta siarka?
– Oddziaływanie złota z siarką jest procesem od dawna znanym i wykorzystanym w chemii. Natomiast my zmodyfikowaliśmy odpowiednio cystynę – naturalny aminokwas, który zawiera mostek disiarczkowy. Cystyna modyfikuje nanoncząstki złota, jednocześnie wprowadzając na jej powierzchnie grupy funkcyjne, które wbudowują się w sieć polimerową. To z jednej strony wpływa na właściwości mechaniczne, a z drugiej strony jest odpowiedzialne za proces self-healingu żelu, ponieważ pod wpływem naświetlania promieniowaniem podczerwonym następuje reorganizacja tych grup na powierzchni. Tzn. jeżeli one ulegną zerwaniu, to zaczynają się odpowiednio odtwarzać – tłumaczy specjalista.
Nie tylko uleczy, ale też sam się naprawi
– Udało nam się otrzymać materiał, który zawiera w sobie nanocząstki złota oraz nanożele i dzięki tym dodatkom nabiera odpowiednich właściwości mechanicznych. Sam z siebie wykazuje self-healing, to znaczy, gdyby się uszkodził – jeżeli ten plaster pęknie – to możemy naświetlić go promieniowaniem podczerwonym i sam się zagoi, dalej odpowiednio spełniając funkcje barierowe. Dodatkową cechą jest to, że przy użyciu promieniowania podczerwonego, możemy w kontrolowany sposób uwalniać substancje czynne, czyli nie dostarczamy leku w sposób ciągły, tylko substancja lecznicza wydostaje się z żelu, gdy naświetlamy go podczerwienią – komentuje naukowiec.
Ponadto materiał ten charakteryzuje się bardzo dobrą adhezyjnością, czyli przyleganiem, do różnych płaszczyzn, również do skóry. Po nałożeniu na ranę nie będzie się przesuwać, co jest ważne z punktu widzenia barierowości, czyli ochrony ran.
– Opracowany przez nas żel oczywiście posiada wszystkie zalety, które mają opatrunki hydrożelowe, a dodatkowo udało nam się wprowadzić trzy nowe funkcje: self-healing samego materiału, kontrolowane uwalnianie leku i bardzo dobrą adhezję do skóry – w telegraficznym skrócie podsumowuje prof. Marcin Karbarz.
Mnogość zalet hydrożeli powoduje, że mogą spełniać różnorodne funkcje, zastępując tradycyjne opatrunki działają jak plaster, gaza lub bandaż. Gdy zawierają substancję leczniczą, stosowane są jako maść. Wykorzystuje się je w roli zaawansowanych układów dostarczających leki. Medycyna coraz uważniej spogląda na nowatorskie hydrożelowe opatrunki.